微生物不同于肉眼可见的动物、植物这些宏体生物,主要是指那些借助显微镜才能看到的微小生物,包括病毒、细菌和古菌,以及大部分单细胞真核生物(如硅藻、颗石藻、放射虫、有孔虫等)。地质微生物区别于肠道微生物、工业微生物、医学微生物等,主要是指参与地质作用的微生物,包括地质时期的微生物以及参与正在进行地质作用(如风化作用、沉积成岩作用等)的现代微生物。地质微生物一般可以从地质环境中分离出来(现代微生物)或者检测到(古代微生物)。
笔者等提出的“四深”微生物主要是指深地、深海、深空和深时环境的微生物,可以简称为“4D微生物”,属于地质微生物。“四深”环境大多数是极端地质环境,“四深”微生物大多数也属于极端地质环境微生物。深地主要是深部地下(deep subsurface)的简称,包括陆地和海底表面以下部分,比一般地质学的深地要浅得多(中国科学院“深部地下生物圈”项目研究组,20201)。这些深度的微生物主要属于黑暗生物圈。有关“四深”微生物的丰度和多样性的认识存在很大的争议。例如,大陆深部微生物的生物量的估算分别有0.25×1030~2.5×1030个细胞(Whitman et al., 1998)、0.5×1030~5×1030个细胞(McMahon et al., 2014)、2×1029~6×1029个细胞(Magnabosco et al., 2018),而海洋深地微生物的生物量估算分别有3.5×1030个细胞(Whitman et al., 1998)、2.9×1029个细胞(Kallmeyer et al., 2012)、5×1029个细胞(Magnabosco et al., 2018)。这些争议主要是由它们存在巨大的空间差异以及研究程度低所造成的。
随着我国深海计划、深地计划和深空计划的大力推进,一系列与“四深”微生物有关的前沿科学问题不断地提出,它们对理解地球生命起源、界定生物圈的边界条件、引发一些重大科学发现和突破、促进地球科学与生命科学以及行星科学之间的交叉融合都具有重要的科学意义。同时,这些微生物蕴含着极其宝贵的种质资源,推动深空、深海和深地等重大工程计划关键技术的突破与创新,极大地影响生物安全、生态安全和资源能源安全,因而具有重要的战略价值。最近出版的《极端地质环境微生物学》对这些微生物及其战略意义进行了系统阐述(国家自然科学基金委员会和中国科学院,2022),这里则分析亟需突破的“四深”微生物引发的一些关键地质作用,以推动我国这一领域的研究。
1 “四深”微生物与气候环境的相互作用
1.1 深海和深地微生物
微生物的生物地球化学功能直接决定了生物与环境之间的相互作用。特别是,微生物并非被动地适应环境,而是具有主动改变环境的能力。例如,地下油气藏的异常环境和地表的酸性矿坑水环境都是不同微生物作用于地质体而形成的极端地质环境。微生物往往有许多特殊基因和独特的生物酶,以适应这些极端环境。这导致了这些微生物具有许多特征性的生物地球化学功能,不仅在工农业生产上得到广泛应用,而且具有很强的影响地球环境的能力。深地微生物对地下油气藏、天然气水合物、页岩气等能源以及金属矿产资源的形成具有重要的贡献。近年发现页岩中的纳米孔隙、石英与长石等“碎屑”矿物、蒙脱石向伊利石转变等都可能由微生物作用形成(谢树成等,2018)。
深海、深地环境的微生物地质作用往往通过许多耦合的生物地球化学过程实现。这既与这些环境有限的能量但丰富的化学物质有关,也与化学反应的热动力学有关。这些耦合的生物地球化学过程使得许多微生物之间出现互养共生,以行使地质作用。耦合过程在理论上是可行的。例如,根据氧化有机碳并还原电子受体所产生的吉布斯自由能大小,微生物依次利用氧气、硝酸盐、锰和铁的氧化物、硫酸盐和甲烷发酵过程来氧化有机碳(Stumm and Morgan,1996)。这样,微生物能量产生过程就受制于这些电子传递反应。氧化有机碳成为二氧化碳可以与还原氧气、硝酸盐、铁锰氧化物和硫酸盐耦合起来。这方面最典型的例子是甲烷厌氧氧化作用与一些还原过程的耦合。在厌氧条件下,微生物介导的甲烷氧化可与硫酸盐还原耦合在一起,也可与硝酸盐还原(Timmers et al.,2017)、铁锰氧化物的还原相耦合(Beal et al., 2009),从而通过影响甲烷循环而对气候变化产生影响。
深地微生物会通过许多地质过程影响地下工程,并具有正负两面性。例如,地下CO2封存越来越受到重视,但它会受到深地微生物的影响,需要研究微生物与微生物之间、微生物与地下岩石矿物之间、微生物与地下流体之间的相互作用及其对地下CO2封存的影响。对于核废料来说,地质储存也是目前公认的、唯一可行的长期安全处置那些半衰期长、高放射性核废料的方法,但深地微生物同样会影响核废料储存库的可靠性和安全性,需要详细了解可能发生的微生物过程,特别是其中的正、反面效应。
当然,深地和深海微生物细胞的代谢速率往往很慢,许多生物地球化学过程进行得也比较缓慢。例如,地下深部细胞的碳代谢速率大约比地表环境低4个数量级(Jørgensen, 2011),深海沉积物底部1 km处古菌产率比表层沉积物低3个数量级(Xie Sitan et al., 2013)。这些环境中生物地球化学过程如此缓慢主要与有限的能量有关。微生物活动也尽量利用那些消耗能量相对低的代谢反应。例如,地下微生物主要利用还原性的乙酰辅酶A途径固碳(Magnabosco et al., 2015),就是一个低耗能代谢实例(Berg, 2011)。
总体上来说,人们对深海、深地环境微生物的地球化学功能还了解得很少。特别是,在这些极端地质环境,微生物与微生物之间,原核微生物与真核生物之间的物质、能量是如何传递和交换的?调控机制又是什么?有哪些生态效应?在全球背景下,“四深”微生物如何反馈作用于气候环境变化?这些都是核心的前沿科学难题。
1.2 深空环境微生物
在深空环境,微生物的研究很少,主要开展的工作是在地球上进行类似天体的极端环境研究。例如,截止2017年,针对太阳系天体特征,已经建立了37个以地球极端环境为参照的天体生物学类比研究点(Martins et al., 2017),包括我国的柴达木盆地。这些类比研究可以帮助回答一系列的重大科学难题,诸如生命是否可以在其他天体上起源、演化和生存?太空环境下微生物群落的物种多样性、适应机理、动力学特征以及维持机制如何?太空环境下有益的植物—微生物如何相互作用,如何建立抑制植物致病菌的生物学方法?这些都是深空探测中面临的重大科学难题。
除了地球上的类比研究,还有就是空间生物舱和临近空间的微生物研究。在空间环境生长的微生物容易表现出不同于地面的一些生物学特征,包括生长速度加快、毒力增加、抗菌抗药性增加、更容易形成生物膜等(国家自然科学基金委员会和中国科学院,2022)。临近空间是海平面之上20~100 km高度的空间范围,是地表环境与近地轨道空间的过渡区,环境非常极端,具有高辐射、低温、干燥、低气压等条件(林巍,2020)。目前发现,在20~40 km高度区域的微生物丰度为104~105个细胞/m3(Bryan et al., 2019),普遍以形成孢子等休眠体的菌株为主。
1.3 深时微生物
地球的宜居性与微生物的正面或负面作用关系密切,氧气的产生及其演变就是一个例子。尽管生命之树根部的微生物大多起源于极端地质环境,但具体的起源时间和各类微生物功能群不同属种的演化等关键问题都很不清楚,这直接影响了某类特定微生物功能群演化树的构建。可以说,目前还没有构建出任何一类微生物功能群可靠的演化树,由此导致这些微生物起源和演化的环境背景以及它们之间的协同演化也很不清楚(国家自然科学基金委员会和中国科学院,2022)。
在自养微生物功能群方面,光合微生物功能群最早起源于太古宙早期(>3200 Ma),且非产氧光合生物要早于产氧光合细菌,且后者出现的时间可能非常接近古元古代大氧化事件所发生的时间(Xiong Jin et al., 2000; Battistuzzi et al., 2004)。因此,太古宙以非产氧光合微生物占主导,古、中元古代以产氧光合原核生物占主导。产氧光合藻类出现的时间要明显晚于大氧化事件,冠群光合藻类的起源时间可能在中元古代晚期(~1100 Ma)(Yoon et al., 2004),藻类在新元古代的初级生产力结构中占据重要地位。这些演化事件对进一步认识早期地球环境演化和大氧化事件的过程有重要意义。进入显生宙,在藻类演化方面,古生代以绿藻占主导,中、新生代则以“红枝”藻类为主导。
分子生物学在氮代谢微生物功能群起源和演化方面取得了一些重要的进展,这些研究表明奇古菌中的氨氧化古菌(Ammonia-oxidizing archaea,AOA)起源于大氧化事件之后,与大气氧气含量升高密切相关,其后续生态位的扩张可能与海洋的氧化过程有关(Ren Minglei et al., 2019)。与AOA相似,氨氧化细菌(Ammonia-oxidizing bacteria,AOB)是一类好氧氨氧化自养细菌,与AOA属于同一功能群,最新的分子生物学表明AOB可能起源于新元古代晚期,与AOA向深海的生态扩张有时间上的联系。这些成果对深入认识氮循环的特征和演化以及地质历史时期氮同位素的解释具有重要价值。
分子生物学还可以揭示很多微生物演化事件与深时极端地质环境之间的关系。在显生宙动物大灭绝期,因古气候、动物生态系统和海洋环境的剧变,使得一些地质微生功能群发生变化,涉及光合自养微生物、甲烷代谢微生物、硫代谢微生物和氮代谢微生物等功能群。在显生宙的5次动物大灭绝期,与初级生产力有关的光合自养微生物都出现了重大变化,特别是蓝细菌和疑源类出现了增加。一些反硝化微生物和固氮微生物因缺氧条件的形成而出现繁盛(Luo Genming et al., 2011; Liu Han et al., 2020)。硫酸盐还原微生物、绿硫细菌、产甲烷微生物和甲烷好氧氧化微生物也很繁盛。通过分子生物学的工作揭示了一类新的产甲烷古菌起源于距今 252 Ma 前后的二叠纪—三叠纪之交(Rothman et al., 2014)。真菌丰度则在二叠纪—三叠纪之交、白垩纪末期出现了峰值。
2 “四深”微生物引发的生物安全和生态灾难
细菌、古菌、真菌和病毒等微生物都能引发生态危机和生物安全,这里仅重点介绍地质环境的病毒对人类社会和生态系统的影响。特别是,地质时期的病毒亟需突破。
2.1 现代病毒与重大疫灾
当前,在生物安全方面比较关注的是病毒。在现代,许多致病病毒往往导致一些疫情的爆发。例如,2020年在全球范围爆发的新型冠状病毒导致的肺炎疫情。在近代,病毒所引发的瘟疫多次对人类文明产生重要影响,像安东尼瘟疫(公元164~180年)导致了古罗马帝国的衰落。被病毒感染致死后的生物遗体存在大量病毒,会进一步对其他生物的生存构成威胁。在死于300年前的冰冻“木乃伊”中就曾发现了天花病毒的基因片段(Biagini et al., 2012)。从“西班牙”流感(1918~1920年)受害者的遗体里提取了基因片段并重建了病毒,发现其致病性远高于现在的流行病毒(Taubenberger et al., 2001)。
深海、深地等极端地质环境都存在许多病毒,并且有研究表明一些未知的远古病毒会从极地冻土中休眠复活,极有可能造成远古病毒的大重返。在青藏高原就发现了28种史前病毒,其DNA没有已知的病毒样本与其匹配,况且这仅仅是冰山一角(Zhong Zhiping et al., 2021)。如果人们对病毒利用不当就会对国家生物安全形成巨大挑战,会出现重大疫情的爆发、生化战,甚至能在短时间内造成全球的流行病疫情等。
在深地方面,洞穴是包括蝙蝠在内的动物重要栖息地,而蝙蝠携带大量的病毒,因此洞穴病毒的多样性、分布及其与宿主之间的关系、潜在的生物安全等也将成为今后洞穴微生物关注的热点。例如,SARS的冠状病毒等均属于洞穴微生物(宿主为蝙蝠),但目前的研究仅局限在洞穴水体病毒的研究中,洞穴其他载体病毒的研究还十分局限。又例如,深地环境的开发利用是否会像打开潘多拉盒子一样,使病毒等微生物得到大范围散播和繁殖?例如在极地冰芯中便检测到了140 ka 前的“蕃茄花叶病毒”,这也是目前已知比较古老的病毒(Castello et al., 1999)。而且在冰芯和冻土层中发现的包括病毒在内的微生物,在室内环境中加热后,病毒等微生物会迅速复活,这足以说明其生命的顽强(Pikuta et al., 2005; Bidle et al., 2007; Legendre et al., 2014)。开展深地环境中病毒的多样性以及它们在生态系统中的作用研究,进而评估它们潜在的致病性,这将极大地提高人们对开发地下空间的生物安全意识,合理科学地规避和控制风险,对地下空间的开发和生物安全指导提供科学依据。
病毒也广泛分布于深海等极端地质环境中,通过侵染和裂解宿主细胞进而作用于许多海洋生态过程。虽然病毒的活动完全依赖于寄生生活,但是病毒与其微生物宿主之间存在着多种复杂的相互作用关系。已有的研究表明,除了作为微生物裂解的主要因素之外,病毒与微生物宿主之间还存在着多种互利互惠的关系,如携带辅助代谢基因(Kieft et al., 2021)、调节宿主的生理代谢作用(Chen Linxing et al., 2020)、促进宿主进化(Chevallereau et al., 2022)等等。在深部环境中,病毒的侵染会诱导宿主的抗氧化反应,从而提高宿主对包括压力在内的多种极端环境适应的能力,最终来协助宿主更好地在深部极端环境中适应及生存。深海病毒对海洋碳循环产生重要影响,纳米尺度的病毒可以产生全球尺度的影响(Brussaard et al., 2008)。然而,人们对深海等极端地质环境病毒的分布、丰度及其适应机制很不清楚,需要加强这方面的突破,包括它的宿主、在各类极端环境的分布规律及其受控因素。
病毒的爆发与宿主的发展有关,而宿主又往往与气候环境变化相关,导致病毒爆发与气候环境之间存在密切的关系。如何准确把握这两者之间的相互作用,需要地球科学与生命科学的交叉融合,更需要地球科学家与生命科学家的联合。在病毒爆发时,生命科学和医学对于防控起了关键作用,但评估病毒的未来发展趋势则需要地球科学家的贡献。宿主与气候环境之间存在的密切关系,不仅造成了病毒引发的区域性乃至全球性的疫情大爆发,而且也有利于人们根据气候环境的变化来预测未来疫情的走向,但这方面的工作还开展得极少。
例如,温度变化可以通过多种途径影响病毒的释放和传播(Danovaro et al., 2011)。全球变暖导致冰川融化,深藏地下40 ka的景观逐渐暴露出来,包括病毒在内的微生物也得以重见天日(Pendleton et al., 2019)。温度的升高在一定范围内会加速宿主细胞的裂解,也会影响病毒及其宿主的生理状态和代谢过程,包括酶的活性等。有研究表明,甲型流感病毒神经氨酸酶的进化和全球温度变化具有明显的相似趋势,并且这种趋势在一些神经氨酸酶的亚型和不同种属中依然存在(Yan Shaomin et al., 2010)。温度变化扩大候鸟等宿主的活动范围而加剧病毒传播,进而出现候鸟迁徙路径变化而引起流感爆发(Newman et al., 2012)。再例如,2002~2004年在北美地区爆发的西尼罗河病毒,其宿主为蚊子,而蚊子生存策略和生理状态明显与气候变化密切相关,导致病毒出现季节性和地区性的差异(Morin et al., 2013; Paull et al., 2017)。
2.2 地质病毒与生物灭绝
如果说现代病毒能引发全球性疫情,那么地质时期病毒的爆发甚至可能引发生物灭绝,包括背景灭绝和大灭绝。对新生代深海沉积物中的颗石藻和浮游有孔虫研究显示,一些物种的灭绝并没有伴随强烈的环境变化,这些生物的背景灭绝与人们熟悉的大灭绝不同,可能是由病毒引起的(Emiliani, 1993)。实际上,人们也曾经根据琥珀中发现的裨虫,提出了白垩纪末期的生物大灭绝也可能是由病毒引发的(Pe alver et al., 2017)。
alver et al., 2017)。
要了解地质时期的病毒(地质病毒)及其所引发的生态灾难,关键是要建立地质病毒的记录。然而,地质病毒很难研究,尽管一些地质微生物功能群可以通过脂类进行研究(谢树成等,2012),但病毒因缺乏细胞膜而难以直接从膜脂角度进行研究。如果说地质微生物比动植物化石难研究,那么古代病毒则是地质微生物中最难研究的。纯化的病毒糖鞘脂(Viral glycosphingolipid,GSL)在北大西洋的颗石藻种群中被检测到,这种颗石藻宿主里的病毒可以通过病毒脂类进行研究(Vardi et al., 2009)。虽然大部分病毒没有细胞膜脂,但会与宿主脂类发生相互作用,可以通过宿主脂类的变化来研究病毒。有研究发现,裂解性病毒感染会诱导宿主细胞合成高饱和三酰甘油(Triacylglycerols,TAGs)以进行细胞脂质体的重塑(Malitsky et al., 2016),这是因为病毒往往将宿主脂类作为侵染作用位点,也还影响宿主脂类代谢途径(Heaton and Randall, 2011; Mazzon and Mercer, 2014)。图1是Paracoccus副球菌属的病毒侵染实验,病毒不仅导致脂肪酸等脂类含量发生大幅度降低,而且还导致单体碳同位素组成的变化。
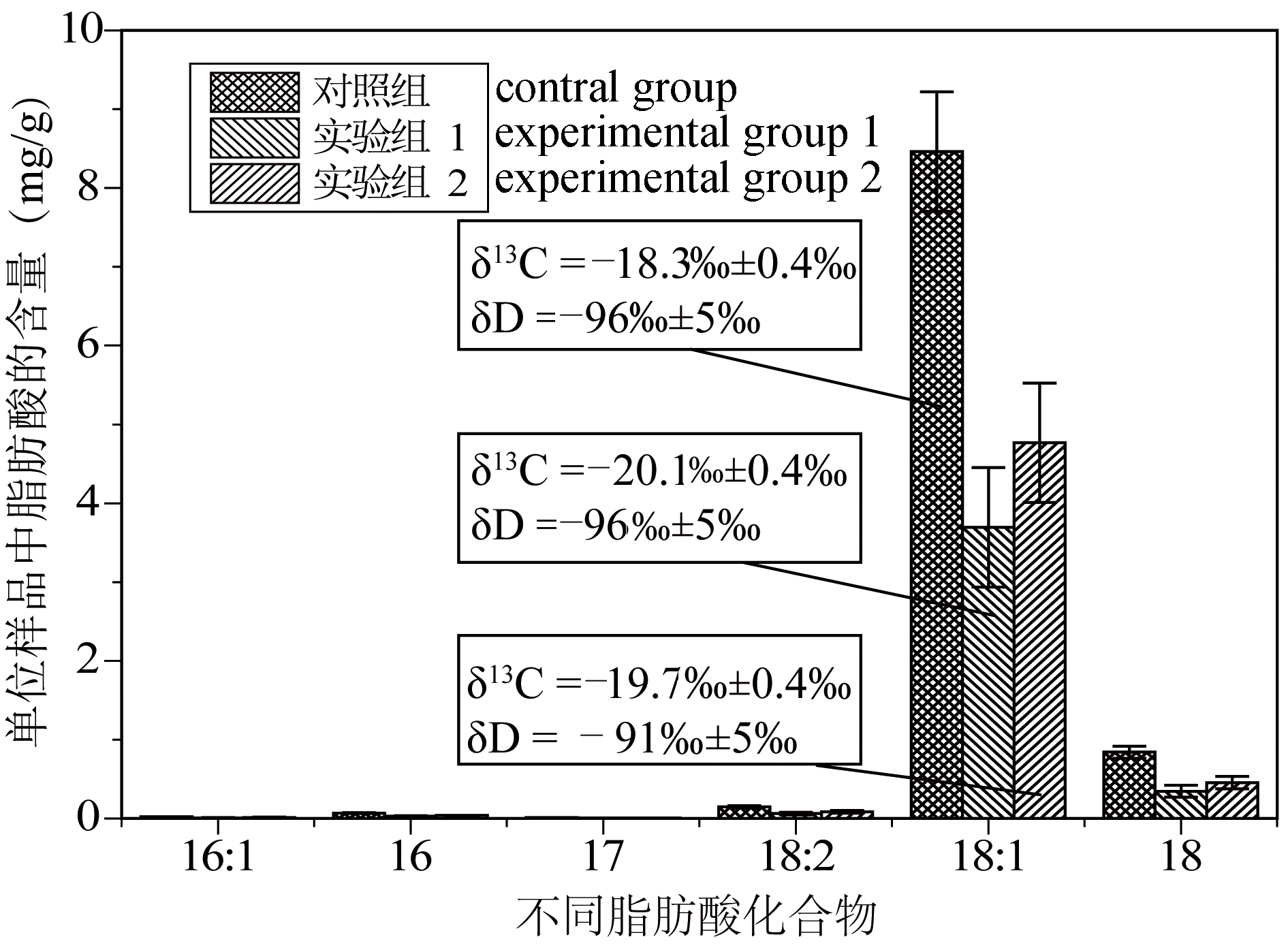
图1 病毒侵染对Paracoccus副球菌脂类分子组成及其单体同位素值的影响
Fig.1 The impact of viral infection on the lipids content and isotope compositions of Paracoccus
对照组为未被病毒侵染的副球菌,实验组1和实验组2为两组经病毒侵染后的副球菌平行样。碳同位素值的相对标准是V-PDB, 氢同位素值的是V-SMOW。横坐标中数字16、17和18表示脂肪酸化合物的碳数,冒号后面的数字表示不饱和度
The control group was uninfected by the virus, and the experimental groups 1 and 2 were the parallel samples of the two groups infected by the virus.The carbon isotope values are expressed relative to V-PDB, and hydrogen isotope values are to V-SMOW.The numbers 16, 17, and 18 on the abscissa indicate the carbon number of the fatty acids, and the numbers after the colon indicate the degree of unsaturation
除了地质脂类以外,病毒也可能参与矿物的合成而留下地质记录。在一些微生物席存在许多病毒,人们发现这些病毒可以通过合成一些矿物而保留下来,特别是那些含有机分子的矿物。利用NanoSIMS(纳米离子探针)对微生物席中病毒形成的矿物开展有机质同位素(如12C14N-)和无机元素同位素(如16O-、28Si-)分析,发现两者的分布形态完全一致,而且也与病毒的形态类似,说明病毒通过合成有机矿物而留下地质证据(Pacton et al., 2014)。
3 “四深”微生物的隐匿地质过程
地质微生物参与了许多的地质和地球化学过程,这些过程都或多或少地在地质记录里保存下来。然而,有些微生物参与的地质过程却难以在地质体里记录下来,称为隐匿的地质过程。这些隐匿的地质过程具有非常重要的意义。
3.1 碳、硫循环
深海和深地环境大多数处于缺氧或无氧状态,这导致生物地球化学循环以厌氧过程为主要特征。例如,碳循环中的还原性乙酰辅酶固碳作用和CH4厌氧氧化作用,氮循环的反硝化作用,硫循环的硫酸盐还原作用,等等。然而,一旦这些厌氧过程受到地表有氧过程的影响,就会产生一些隐匿(cryptic)的地质过程。之所以称为“隐匿”,是因为这些地质过程确实发生了,但后来因环境变动其形成的产物很快又消失了,难以在地质环境里检测到或者不能在地质记录里留下证据。
例如,在智利北部海岸的缺氧水体里,硫酸盐还原过程产生的H2S很快又被氧化成硫酸盐,这个隐匿的硫循环实际上是与厌氧氨氧化和其他相关的氮循环联合在一起的,所以对全球海洋的生物地球化学循环具有重要的影响(Canfield et al., 2010)。这是海水里的情况。实际上,在沉积物里也会出现隐匿的硫循环,即产生的H2S很快被Fe(III)氧化成硫酸盐。人们甚至在沉积物里还发生隐匿的甲烷循环。例如,在南海沉积物的硫酸盐还原带存在一个隐匿的甲烷循环,即大分子有机化合物被降解为小分子,并经产甲烷菌形成甲烷,这些甲烷很快被氧化成CO2而消失(Zhuang Guangchao et al., 2019),也就是产甲烷、甲烷厌氧氧化、硫酸盐还原同时进行。
3.2 活性氧自由基
自由基是含有不成对电子的原子团,这种热力学不稳定性使自由基具有夺取或失去电子的反应活性。生物体系遇到的主要是活性氧自由基(Reactive Oxygen Species,ROS),包括超氧阴离子(O2·-)、过氧化氢(H2O2)、羟自由基(·OH)、一氧化氮自由基(NO·)等。它们在生物体里发挥双重作用,早期认为自由基具有破坏细胞组分和引起突变和衰老等“负面”作用,后来认识到自由基还具有免疫和信号传导等“正面”作用(图2)。因而,细胞里的活性氧自由基对生命的影响是生命科学乃至医学非常关注的主题。
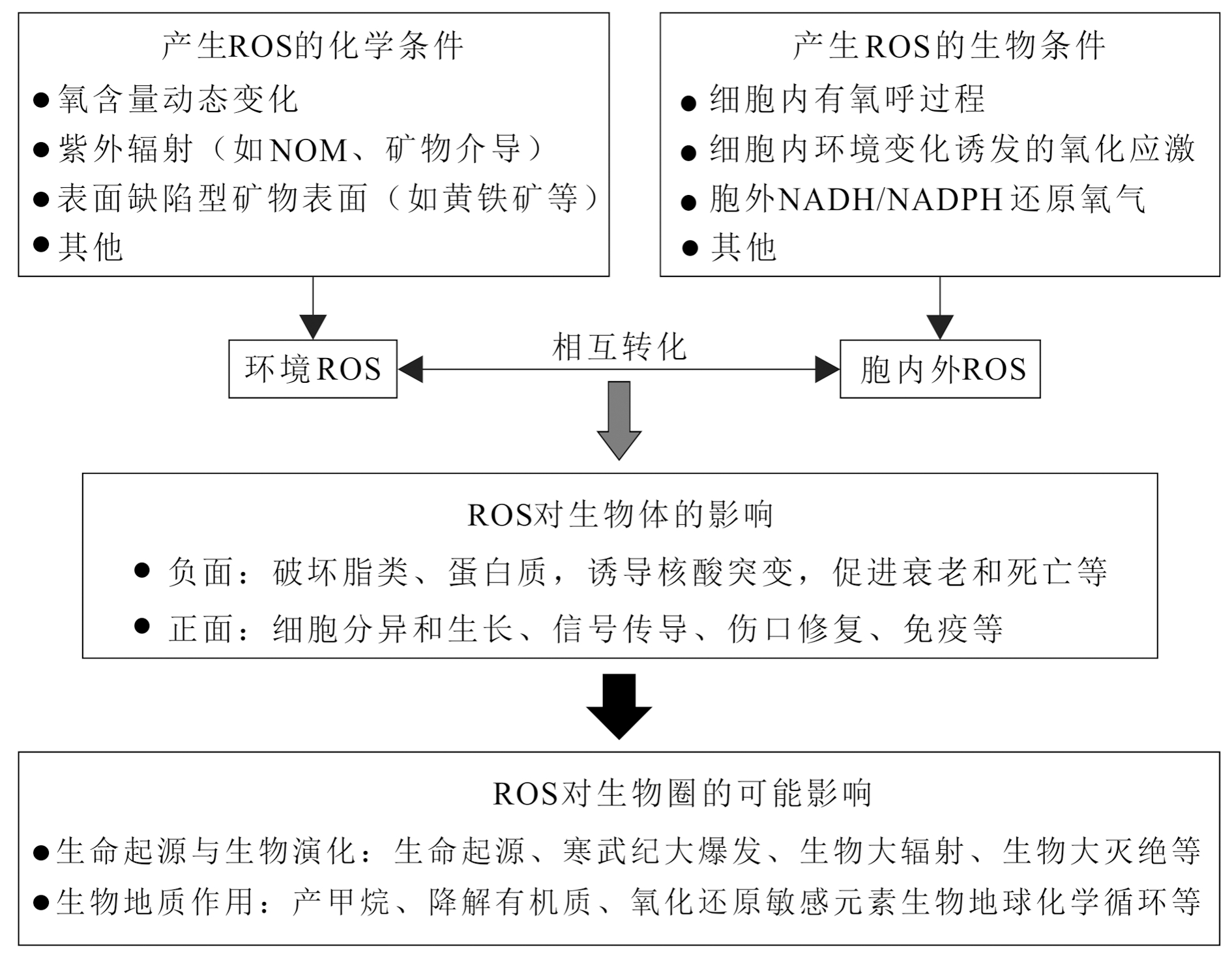
图2 地质环境的活性氧自由基对生物不同层次的可能影响
Fig.2 Possible effects of active oxygen species in geological environment on different levels of organisms
在地质环境,许多物理、化学和生物条件有助于环境介质和生物体产生ROS,特别是在环境条件频繁变化的热力学非稳态条件(图2)。例如,在前寒武纪的低氧环境下,Fe(II)有助于产氧光合细菌产生ROS(Swanner et al., 2015);强烈的紫外线作用可以在黄铁矿等半导体矿物表面产生ROS;一些深海异养细菌也可以在胞外通过NADH(还原型烟酰胺腺嘌呤二核苷酸)还原氧气产生ROS(Diaz et al., 2013)。ROS经常瞬时产生,但又很快消失,地质体里因此存在许多这样的隐匿过程,并对微生物地质过程和生物演化产生影响。最近发现,生物体内ROS、铁和甲基供体的相互作用使得所有好氧生物都能参与甲烷的形成(Ernst et al., 2022)。寒武纪生命大爆发也可能与ROS导致的基因突变有关(Yang Dong et al., 2018)。在诸如显生宙5次生物大灭绝、寒武纪生命大爆发、奥陶纪生物大辐射等时期,当时地质环境的自由基是如何变化的,它们对生物演化又产生怎样的影响,这些谜团有待于破解。从细胞水平到地质环境的ROS变化对生命系统的影响,特别是对微生物代谢、微生物地球化学过程、微生物演化的影响,需要地球科学、生命科学和化学等学科的交叉融合才能取得重大突破。
4 结论
随着地球生物学研究的不断深入,人们发现有关生物对地质环境的影响越来越重要。其中的一个关键环节是地质微生物,而深海、深地、深空和深时环境的微生物是这其中关键环节中的关键。这些环境中的地质微生物大部分属于极端地质环境微生物。
“四深”微生物不断地与气候环境发生相互作用,导致它们之间出现协同演化,并最终形成现代人们所看到的宜居地球环境。“四深”微生物还与生物安全、生态安全密切相关,特别是人们对地质时期的病毒及其对生态系统的影响还一无所知。尽管人们提出了病毒可能会对生物的背景灭绝和大灭绝产生影响,但到目前为止还没有确切的病毒地质记录,亟待尽快突破。“四深”微生物还参与了地质环境许多隐匿的生物地球化学过程,特别是,地质环境的活性氧自由基如何影响微生物及其地质作用还有待突破。
谨以此文祝贺杨文采主编80华诞!
(The literature whose publishing year followed by a “&” is in Chinese with English abstract; The literature whose publishing year followed by a “#” is in Chinese without English abstract)
国家自然科学基金委员会, 中国科学院.2022.极端地质环境微生物学.北京: 科学出版社: 1~303.
林巍.2020.临近空间生物研究及其天体生物学意义.科学通报, 65(14): 1297~1304.
谢树成, 杨欢, 罗根明, 黄咸雨, 刘邓, 王永标, 龚一鸣, 徐冉.2012.地质微生物功能群: 生命与环境相互作用的重要突破口.科学通报, 57(1): 3~22.
谢树成, 殷鸿福, 刘邓, 邱轩.2018.再谈古生物学向地球生物学的发展:服务领域的拓展与创新.地球科学, 43(11): 3823~3836.
中国科学院“深部地下生物圈”项目研究组.2020.深部地下生物圈.北京: 科学出版社.
Battistuzzi F U, Feijao A, Hedges S B.2004.A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land.BMC Evolutionary Biology, 4: 44.
Beal E J, House C H, Orphan V J.2009.Manganese-and iron-dependent marine methane oxidation.Science, 325(5937): 184~187.
Berg I A.2011.Ecological aspects of the distribution of different autotrophic CO2 fixation pathways.Applied and Environmental Microbiology, 77: 1925~1936.
Biagini P, Thèves C, Balaresque P, Géraut A, Cannet C, Keyser C, Nikolaeva D, Gérard P, Duchesne S, Orlando L, Willerslev E, Alekseev A N.2012.Flaws in the Medicare readmission penalty.The New England Journal of Medicine, 367(21): 2056~2057.
Bidle K D, Lee S, Marchant D R, Falkowski P G.2007.Fossil genes and microbes in the oldest ice on Earth.Proceedings of the National Academy of Sciences, 104(33): 13455~13460.
Brussaard C P, Wilhelm S W, Thingstad F, Weinbauer M G, Bratbak G, Heldal M, Kimmance S A, Middelboe M, Nagasaki K, Paul J H.2008.Global-scale processes with a nanoscale drive: the role of marine viruses.International Society for Microbial Ecology Journal, 2(6): 575~578.
Bryan N C, Christner B C, Guzik T G, Granger D J, Stewart M F.2019.Abundance and survival of microbial aerosols in the troposphere and stratosphere.The International Society of Microbial Ecology Journal, 13: 2789~2799.
Canfield D E, Stewart F J, Thamdrup B, De Brabandere L, Dalsgaard T, Delong E F, Revsbech N P, Ulloa O.2010.A cryptic sulfur cycle in oxygen-minimun-zone waters off the Chilean coast.Science, 330: 1375~1378.
Castello J D, Rogers S O, Starmer W T, Catranis C M, Ma Lijun, Bachand G D, Zhao Yinghao, Smith J E.1999.Detection of tomato mosaic tobamovirus RNA in ancient glacial ice.Polar Biology, 22: 207~212.
Chen Linxing, Meheust R, Crits-Christoph A, Mcmahon K D, Banfield J.2020.Large freshwater phages with the potential to augment aerobic methane oxidation.Nature Microbiology, 5(12): 1504~1515.
Chevallereau A, Pons B J, Van Houte S, Westra E R.2022.Interactions between bacterial and phage communities in natural environments.Nature Review Microbiololgy, 20(1): 49~62.
Danovaro R, Corinaldesi C, Dell'anno A,Fuhrman J A, Middelburg J J, Noble R T, Suttle C A.2011.Marine viruses and global climate change.Federation of European Microbiological Societies Microbiololgy Reviews, 35(6): 993~1034.
Diaz J M, Hansel C M, Voelker B M, Mendes C M, Andeer P F, Zhang T.2013.Widespread production of extracellular superoxide by heterotrophic bacteria.Science, 340: 1223~1226.
Emiliani C.1993.Extinction and viruses.BioSystems, 31: 155~159
Ernst L,Steinfeld B, Barayeu U, Klintzsch T, Kurth M, Grimm D, Dick T P, Rebelein J G, Bischofs I B, Keppler F.2022.Methane formation driven by reactive oxygen species across all living organisms.Nature, 603: 482~487.
Heaton N S, Randall G.2011.Multifaceted roles for lipids in viral infection.Trends in Microbiology, 19(7): 368~375.
Jorgensen B B.2011.Deep subseafloor microbial cells on physiological standby.Proceedings of the National Academy of Sciences of the United States of America, 108: 18193~18194.
Kallmeyer J, Pockalny R, Adhikari R R,Smith D C, D'Hondt S.2012.Global distribution of microbial abundance and biomass in subseafloor sediment.Proceedings of the National Academy of Sciences of the United States of America, 109: 16213~16216.
Kieft K, Zhou Z, Anderson R E, Buchan A, Anantharaman K.2021.Ecology of inorganic sulfur auxiliary metabolism in widespread bacteriophages.Nature Communication, 12(1): 3503.
Legendre M, Bartoli J, Shmakova L, Jeudy S, Labadie K, Adrait A, Lescot M, Poirot O, Bertaux L, Bruley C, Coute Y, Rivkina E, Abergel C, Claverie J M.2014.Thirty-thousand-year-old distant relative of giant icosahedral DNA viruses with a pandoravirus morphology.Proceedings of the National Academy of Sciences of the United States of America, 111(11): 4274~4279.
Lin Wei.2020#.Life in the near space and implications for astrobiology.Chinese Science Bulletin, 65(14): 1297~1304.
Liu Han, Li Ping, Wang Helin, Qing Chun, Tan Tian, Shi Bo, Zhang Guanglong, Jiang Zhou, Wang Yanhong, Hasan S Z.2020.Arsenic mobilization affected by extracellular polymeric substances(EPS)of the dissimilatory iron reducing bacteria isolated from high arsenic groundwater.Science of the Total Environment, 735: 139501.
Luo Genming, Kump L R, Wang Yongbiao, Tong Jinnan, Arthur M A, Yang Huan, Huang Junhua, Yin Hongfu, Xie Shucheng.2011.Isotopic evidence for an anomalously low oceanic sulfate concentration following end-Permian mass extinction.Earth and Planetary Science Letters, 300: 101~111.
Magnabosco C, Ryan K, Lau M C,Kuloyo O, Lollar B S, Kieft T L, Van Heerden E, Onstott T C 2015.A metagenomic window into carbon metabolism at 3 km depth in Precambrian continental crust.The International Society of Microbial Ecology Journal, 10: 730~741.
Magnabosco C, Lin L H, Dong H, Bomberg M, Ghiorse W, Stan-Lotter H, Pedersen K, Kieft T L, Van Heerden E, Onstott T C.2018.The biomass and biodiversity of the continental subsurface.Nature Geoscience, 11: 707~717.
Malitsky S, Ziv C, Rosenwasser S, Zheng S, Schatz D, Porat Z, Ben-Dor S, Aharoni A, Vardi A.2016.Viral infection of the marine alga Emiliania huxleyi triggers lipidome remodeling and induces the production of highly saturated triacylglycerol.New Phytologist, 210(1): 88~96.
Martins Z, Cottin H, Kotler J M, Carrasco N, Westall F.2017.Earth as a tool for astrobiology—A European perspective.Space Science Reviews, 209: 43~81.
Mazzon M, Mercer J.2014.Lipid interactions during virus entry and infection.Cell Microbiology, 16(10): 1493~1502.
McMahon S, Parnell J.2014.Weighing the deep continental biosphere.Federation of European Microbiological Societies Microbiology Ecology, 87: 113~120.
Morin C W, Comrie A C.2013.Regional and seasonal response of a West Nile virus vector to climate change.Proceedings of the National Academy of Sciences of the United States of America, 110(39): 15620~15625.
National Natural Science Foundation of China, Chinese Academy of Sciences.2022#.Microbiology of extreme geological environments.Beijing: Science Press: 1~303.
Newman S H, Hill N J,Spragens K A, Janies D, Voronkin I O, Prosser D J, Yan B, Lei F, Batbayar N, Natsagdorj T, Bishop C M, Butler P J, Wikelski M, Balachandran S, Mundkur T, Douglas, D C, Takekawa J Y.2012.Eco-virological approach for assessing the role of wild birds in the spread of avian influenza H5N1 along the Central Asian Flyway.PLoS One, 7(2): e30636.
Pacton M, Wacey D, Corinaldesi C, Tangherlini M, Kilburn M R, Gorin G E, Danovaro R, Vasconcelos C.2014.Viruses as new agents of organomineralization in the geological record.Nature Communications, 5: 4298.
Paull S H, Horton D E, Ashfaq M, Rastog D, Kramer L D, Diffenbaugh N S, Kilpatrick A M.2017.Drought and immunity determine the intensity of West Nile virus epidemics and climate change impacts.Proceedings Biological Sciences, 284(1848).
Pe alver E, Arillo A, Delclòs X, Peris D, Grimaldi D A, Anderson S R, Nascimbene P C, La Fuente R P.2017.Ticks parasitised feathered dinoaurs as revealed by Cretaceous amber assemblages.Nature Communications, 8(1): 1924.
alver E, Arillo A, Delclòs X, Peris D, Grimaldi D A, Anderson S R, Nascimbene P C, La Fuente R P.2017.Ticks parasitised feathered dinoaurs as revealed by Cretaceous amber assemblages.Nature Communications, 8(1): 1924.
Pendleton S L, Miller G H, Lifton N, Lehman S J, Southon J, Crump S E, Anderson R S.2019.Rapidly receding arctic Canada glaciers revealing landscapes continuously ice-covered for more than 40,000 years.Nature Communications, 10(1): 445.
Pikuta E V, Marsic D, Bej A, Tang J, Krader P, Hoover R B.2005.Carnobacterium pleistocenium sp.nov., a novel psychrotolerant, facultative anaerobe isolated from permafrost of the Fox Tunnel in Alaska.Int.J.Syst.Evol.Microbiol., 55(1): 473~478.
Ren Minglei, Feng Xiaoyuan, Huang Yongjie, Wang Hui, Hu Zhong, Clingenpeel S, SwanB K, Fonseca M M, David P, Stepanauskas R, Hollibaugh J T, Foster P G, Woyke T, Luo Haiwei.2019.Phylogenomics suggests oxygen availability as a driving force in Thaumarchaeota evolution.The International Society of Microbial Ecology Journal, 13: 2150~2161.
Research Group of Deep Subsurface Biosphere, Chinese Academic of Sciences.2020#.Deep Subsurface Biosphere.Beijing: Science Press.
Rothman D H, Fournier G P, French K L, Alm E J, Boyle E A, Cao Changqun, Summons R E.2014.Methanogenic burst in the end-Permian carbon cycle.Proceedings of the National Academy of Sciences of the USA, 111: 5462~5467.
Stumm W, Morgan J J.1996.Aquatic Chemistry 3rd edn.John Wiley, New York, NY USA.
Swanner E D, Mloszewska A M, Cirpka O A, Schoenberg R, Konhauser K O, Kappler A.2015.Modulation of oxygen production in Archaean oceans by episodes of Fe(II)toxicity.Nature Geoscience, 8: 126~130.
Taubenberger J K, Reid A H, Janczewski T A, Fanning T G.2001.Characterization of the 1918 influenza virus hemagglutinin and neuraminidase genes.International Congress Series, 1219: 545~549.
Timmers P H, Welte C U, Koehorst J J, Plugge C M, Jetten M M S, Stams A J M.2017.Reverse methanogenesis and respiration in methanotrophic archaea.Archaea, 2017: 1654237.
Vardi A,Van Mooy B A S, Fredricks H F, Popendorf K J, Ossolinski J E, Haramaty L, Bidle K D.2009.Viral glycosphingolipids induce lytic infection and cell death in marine phytoplankton.Science, 326: 861~865.
Whitman W B, Coleman D C, Wiebe W J.1998.Prokaryotes: the unseen majority.Proceedings of the National Academy of Sciences of the United States of America, 95: 6578~6583.
Xie Shucheng,Yang Huan, Luo Genming, Huang Xianyu, Liu Deng, Wang Yongbiao, Gong Yiming, Xu Ran.2012#.Geomicrobial functional groups: A window on the interaction between life and environments.Chinese Science Bulletin, 57(1): 3~22.
Xie Shucheng, Yin Hongfu, Liu Deng, Qiu Xuan.2018&.On development from paleontology to geobiology: Overview of innovation and expansion of application fields.Earth Science, 43(11): 3823~3836.
Xie Sitan, Lipp J S, Wegener G, Ferdelman T G, Hinrichs K U.2013.Turnover of microbial lipids in the deep biosphere and growth of benthic archaeal populations.Proceedings of the National Academy of Sciences of the United States of America, 110: 6010~6014.
Xiong Jin, Fischer W M, Inoue K, Nakahara M, Baue C E.2000.Molecular evidence for the early evolution of photosynthesis.Science, 289: 1724~1730.
Yang Dong, Guo Xuejun, Xie Tian, Luo Xiaoyan.2018.Reactive oxygen species may play an essential role in driving biological evolution: The Cambrian Explosion as an example.Journal of Environmental Sciences, 63: 218~226.
Yan Shaomin, Zuo Wenpu, Zhu Qixia, Huang Yanyan, Pan Lixia, Wu Guang.2010.Trends in Global Warming and Evolution of Neuraminidases from Influenza A Virus since 1918.Guangxi Sciences, 17(1): 80~84.
Yoon H S, Hackett J D, Ciniglia C, Pinto G, Bhattacharya D.2004.A molecular timeline for the origin of photosynthetic eukaryotes.Molecular Biology and Evolution, 21: 809~818.
Zhong Zhiping, Tian Funing, Roux S, Gazitúa M C, Solonenko N E, Li Yuehfen, Davis M E, Van Etten J L, Mosley-Thompson E, Rich V I, Sullivan M B, Thompson L G.2021.Glacier ice archives nearly 15,000-year-old microbes and phages.Microbiome, 9(1): 160.
Zhuang Guangchao, Xu Lei, Liang Qiangyong, Fan Xibei, Xia Zhen, Joye S B, Wang Fengping.2019.Biogeochemistry, microbial activity, and diversity in surface and subsurface deep-sea sediments of South China Sea.Limnology and Oceanography, 10.1002/lno.11182.